バイオセンサー
我々の体を構成する細胞を覆う生体膜上には、イオンチャネルと呼ばれる膜タンパク質(膜輸送体)が存在し、細胞活動の維持に必須となるイオンを運ぶ役割を担っています。このイオンチャネルに異常が生じると重篤な疾患へと繋がることから、人工イオンチャネルを利用し、異常が生じたイオンチャネルの機能を代替することで、新たな治療法の確立に繋がることが期待されています。人工イオンチャネルは、神経や筋肉の活動を鋭敏に感知するバイオセンサーとしての応用も期待できます。
人工イオンチャネル
DNAオリガミ技術(DNAナノテクノロジー)を用いて、選択的イオン透過機能を有する人工イオンチャネルの構築を目指しています。DNAを材料とした人工チャネルでは、DNAの塩基配列を設計することでチャネル構造を自在に設計できるため製作法として自由度が高く、理論的設計指針に基づいて柔軟に設計・製作が可能です。実験グループと協力しながら、実験・理論の両面から人工チャネルの設計を行っています。分子シミュレーションを用いて、DNAチャネル内部の細孔径の調整や修飾分子により透過分子の選択性を制御したり、脂質二重膜への結合安定性を評価したりし、理論的に設計指針の最適化を行っていきます。
Six-helix bundle (6HB) DNA nanopore
研究テーマの例
人工DNAチャネルのイオン輸送における細孔径の影響
DNAナノテクノロジーを用いて作成された人工DNAチャネルを用いて、イオン輸送の中でも細孔径への輸送依存性に着目し、より機能的な人工合成チャネルの作成を目指します。
人工DNAチャネルのイオン輸送における官能基の影響
人工DNAチャネル内部に任意の官能基を修飾し、官能基がイオン輸送特性に与える影響について調査することで、チャネル内部における分子レベルの構造的・化学的性質に着目して人工DNAチャネルの選択的透過性の発現を目指します。
選択的プロトン輸送を実現する人工チャネルの開発に向けて
プロトン(H+)の輸送は、他のイオンと異なり、Grotthuss機構と呼ばれる水分子との化学反応を伴う複雑な機構を考慮する必要があります。本研究では量子化学計算の結果を基に独自に構築した反応MDモデルを用いて、ナノポア内部の水分子の水素結合ネットワーク構造とイオン伝導メカニズムとの相関を明らかにします。
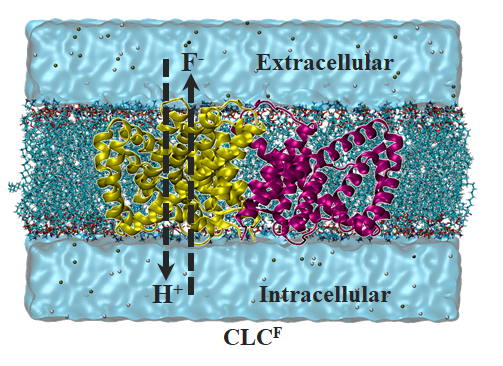
F-/H+交換輸送体(CLCF) のイオン輸送メカニズムの解明
人工イオンチャネルの設計に当たって、天然のイオンチャネルの構造や機能を理解することは非常に重要です。そこで、様々な天然イオンチャネルを対象に、分子シミュレーションを用いてイオン輸送メカニズムの解明を目指しています。例えば、フッ化物イオン(F-)を取り扱う「F-/H+交換輸送体(CLCF)」の研究もその1つです。F-は細菌におけるエネルギー生成などの生存に関わる機能として重要であり、CLCFを介して細胞内におけるF-濃度を調節する働きを持っています。イオンチャネルに異常が起こることによる濃度の著しい変化は細菌の死滅に繋がります。
膜貫通
高機能な人工DNAチャネルを設計しても膜貫通しなければ機能は発現できません。最新の研究においても実験的な人工DNA分子の膜貫通の割合は2割程度に留まっており、収率向上も大きな課題の一つです。リポソーム形成による曲率や電場、イオン種・濃度の影響など、膜貫通を駆動するDNAチャネルと脂質二重膜間の相互作用特性との相関を系統的に評価し、膜貫通プロセスの最適化を行っています。
ドラッグデザイン
液–液相分離(LLPS)
タンパク質やRNAが自己集合することで液–液相分離し、細胞内に液滴やゲル状の構造体を形成することが知られています。細胞は、生体分子を液滴にすることで、転写、翻訳、シグナル伝達など、様々な生命現象を調節していると考えられています。本研究は実験グループとの共同研究であり、エラスチン様ポリペプチド(ELP: Elastin-like polypeptides)など相分離するタンパク質を基盤材料として人工分子を理論的に設計します。細胞内相分離のボトムアップ的な理解を進めると同時に、特定の分子を液滴に閉じ込めることで細胞内の狙ったタンパク質の機能を制御する手法の開発を目指しています。
ELP coacervate formation
研究テーマの例
ELP内アミノ酸残基付加による相分離形成への影響
各種アミノ酸残基を組み込んだELPを基盤とした分子の理論設計を行っています。液滴内のイオン分布や分子間相互作用についての解析を行い、様々な環境下におけるLLPS形成メカニズムの解明とターゲット分子の取り込み制御を目指します。
RNA partitioning in the ELP coacervate
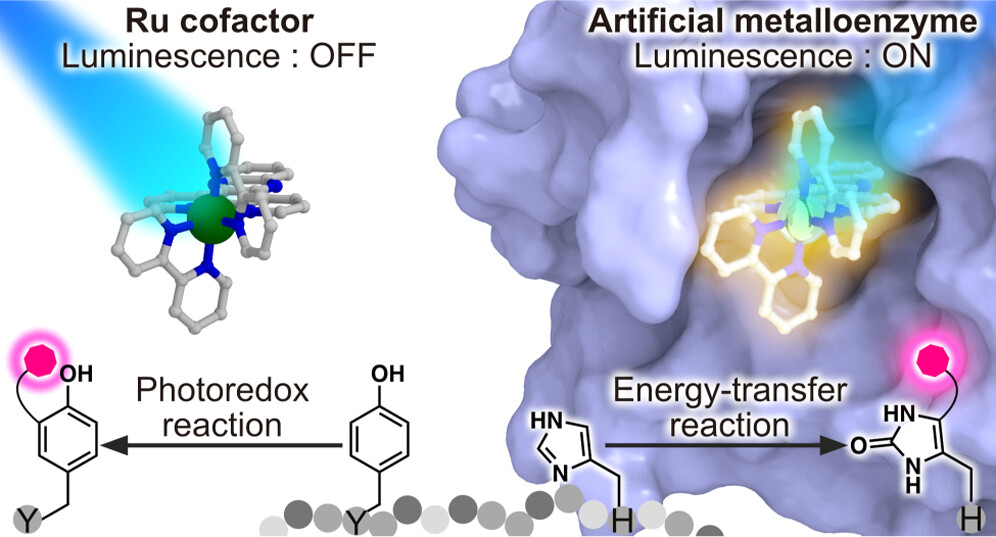
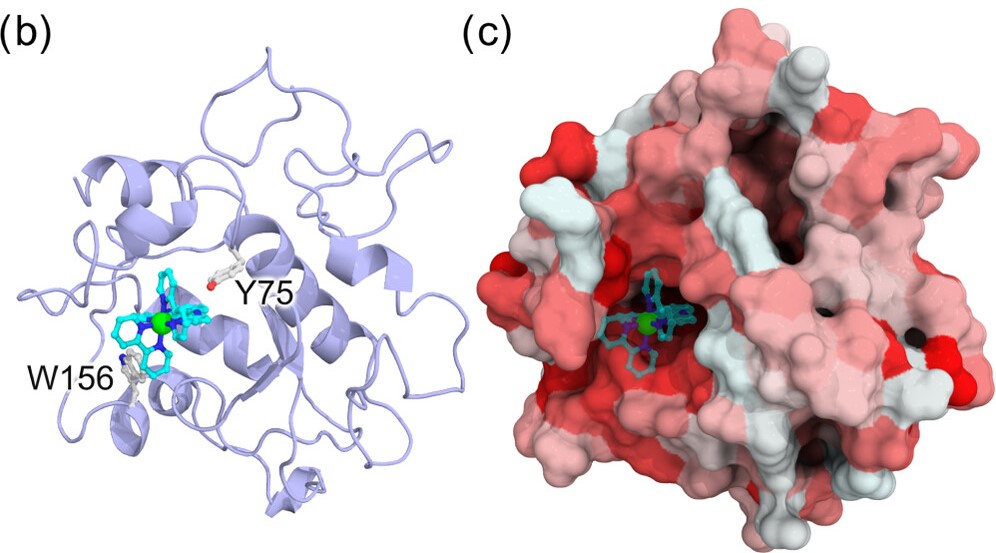
人工酵素
金属錯体をタンパク質の内部空間へと導入することで得られる人工金属酵素では、反応速度の向上や反応選択性の付与などタンパク質に由来する特徴を金属錯体の触媒能に付加することが可能です。合成触媒による非天然反応を生化学反応ネットワークに自在に組み込むことができれば、合成触媒が新たな医薬候補として期待できます。金属錯体の生体適合性を達成しつつ、より汎用な細胞内触媒反応系の確立が重要です。本研究では、実験グループとの共同研究として理論と実験アプローチを融合することにより、実験グループが行っている人工金属酵素の設計を分子シミュレーションを用いて理論的観点からサポートし、より効率的な設計を目指しています。